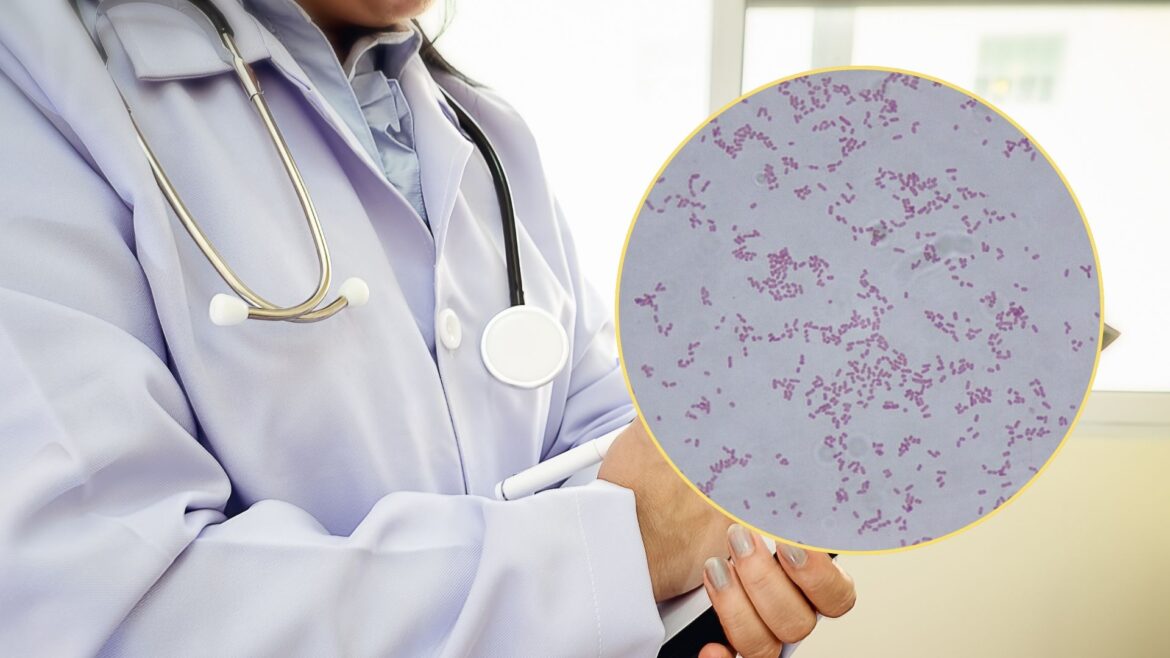
La Secretaría de Salud (SSa) ha informado sobre la detección y atención de un brote de Infección del Torrente Sanguíneo (ITS) causado por Klebsiella oxytoca multidrogo resistente (MDR) en cuatro unidades médicas del Estado de México. De los 20 casos identificados, 15 han sido confirmados como infectados por Klebsiella oxytoca MDR, mientras que los demás permanecen bajo investigación.
Las autoridades del Estado de México notificaron el brote, lo que llevó a la inmediata instalación del Comando de Gestión de Incidentes en Salud Pública, con el fin de investigar el origen del brote. La Secretaría de Salud Federal, a través de la Dirección General de Epidemiología (DGE), el Instituto de Diagnóstico y Referencia Epidemiológicos (InDRE), la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) y la Secretaría de Salud del Estado de México trabajan de manera coordinada en la investigación.
Los casos están relacionados con soluciones intravenosas de nutrición parenteral (NPT) o los insumos utilizados para su aplicación. Las investigaciones iniciales apuntan a una posible contaminación de las soluciones NPT producidas por la empresa SAFE, aunque no se descartan otras hipótesis. Hasta el momento, 13 de los pacientes infectados, todos pediátricos, han fallecido, aunque algunos tenían comorbilidades. Actualmente, siete pacientes continúan hospitalizados recibiendo atención médica.
Como medida preventiva, el 3 de diciembre se emitió una Alerta Epidemiológica para alertar al Sistema Nacional de Salud, y el 4 de diciembre, COFEPRIS suspendió el uso y la administración de soluciones intravenosas de nutrición parenteral (NPT) fabricadas desde el 21 de noviembre por la empresa Productos Hospitalarios, S.A. de C.V.
De acuerdo con la dependencia, el Gobierno de México implementa acciones en torno al establecimiento de definiciones operacionales y mecanismos de difusión, emisión de la Alerta Epidemiológica, refuerzo de la vigilancia epidemiológica por laboratorio en colaboración con el Laboratorio Estatal de Salud Pública (LESP) y el InDRE, investigación y recolección de cepas para análisis genómico, e investigación de COFEPRIS para rastrear los insumos contaminados.
La Secretaría de Salud reitera su compromiso con la seguridad de los pacientes y exhorta al personal de salud, tanto de unidades públicas como privadas, a notificar inmediatamente cualquier caso probable a la Dirección General de Epidemiología (DGE), la Red Hospitalaria de Vigilancia Epidemiológica y a las autoridades locales.